2024年,我校药学院李家明教授团队、马晓东副教授/汪洋副研究员团队分别以安徽中医药大学为第一单位,先后在药物化学领域顶级期刊《Journal of Medicinal Chemistry》(以下简称为JMC)上发表两篇研究性长文,标志着我校药物化学学科在创新药物设计领域高水平论文发表上取得了新突破。JMC是美国化学会(ACS)旗下药物化学领域最具国际影响力的专业性期刊,许多上市药物的研究过程均报道于该期刊。
2024年2月,李家明教授团队在JMC上,以“Design, Synthesis, and Biological Evaluation of Pierardine Derivatives as Novel Brain-Penetrant and In Vivo Potent NMDAR-GluN2B Antagonists for Ischemic Stroke Treatment”为题,报道了抗缺血性脑卒中(IS)药物研发方面的新进展。
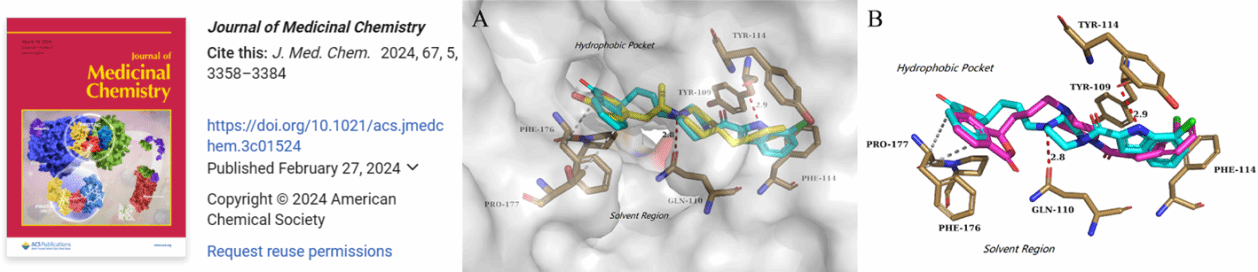
GluN2B NMDAR是包括IS在内的多种神经退行性疾病的潜在治疗靶点,但现有GluN2B NMDAR拮抗剂存在脱靶效应、心血管毒性等不足。该研究将中药活性成分的结构改造与基于生物学靶标的药物设计有机融合,对团队前期通过计算机虚拟筛选得到的NMDAR-GluN2B拮抗剂——天宫石斛活性成分Pierardine进行结构衍生,所发现的代表性化合物Cpd. 58具有优良的NMDAR-GluN2B亲和力和拮抗活性。随后,团队对Cpd. 58开展了手性拆分,并采用X-ray单晶衍射确证了对映异构体的绝对构型。其中,S-58在膜片钳实验中展现出更优的GluN2B NMDAR拮抗活性,且靶标特异性优良;其体内药效与上市GluN2B NMDA选择性拮抗剂ifenprodil相当,并兼具良好的脑暴露量与安全性。除体内外药效学与药动学研究外,团队还借助氨基酸残基突变,确证了S-58的受体结合位点。目前,Cpd. S-58作为潜在的抗IS候选药物,正进行临床前研究。李家明教授为该论文的通讯作者,我校中药学专业博士研究生林高峰为论文的第一作者。
2024年7月,马晓东副教授/汪洋副研究员团队在JMC上,以“Directly Suppressing MYC Function with Novel Alkynyl-Substituted Phenylpyrazole Derivatives that Induce Protein Degradation and Perturb MYC/MAX Interaction”为题,报道了靶向“难成药”(“Undruggable”)蛋白MYC的抗肿瘤药物研发方面的新进展。
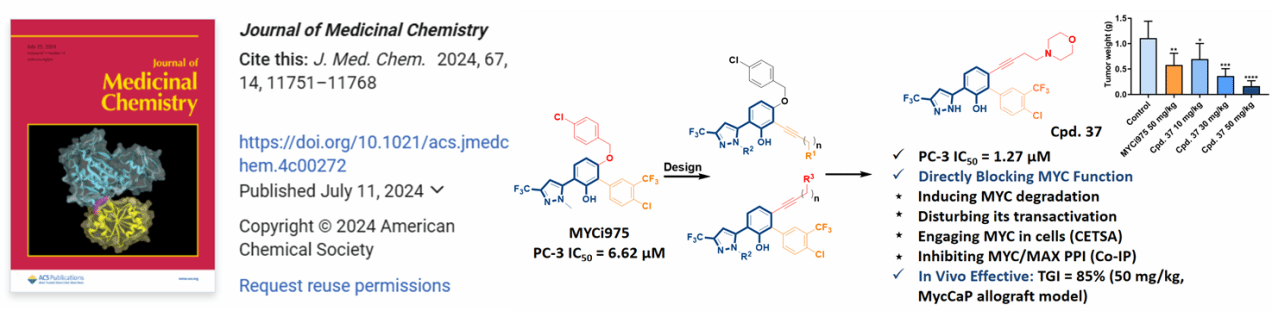
核转录因子MYC过表达于70%以上的恶性肿瘤,抑制其功能有望获得广谱抗癌效果,但因其天然无序性和缺乏典型的小分子结合口袋,其小分子抑制剂的研发征途漫漫,充满挑战。该研究通过开展基于结构的药物设计、合成、体外抗肿瘤活性筛选、基于多种化学生物学手段的靶标确证、体内药代动力学、体内异种移植瘤及同种移植瘤的药效学评价,发现了体内外抗前列腺癌活性俱佳、MYC靶向性明确的化合物Cpd. 37,其体内药效显著优于近年来报道的代表性MYC小分子抑制剂MYCi975。目前,Cpd. 37正作为候选分子开展后续研究。马晓东副教授、汪洋副研究员与碳云智能(iCarbonX)深圳碳云智肽药物科技有限公司占文虎博士为论文的共同通讯作者,我校药物化学专业硕士研究生赵灿、赵芳和杨柳青为共同一作。该论文为靶向MYC的抗癌药物研发提供了重要借鉴,其亮点内容先后获得ACS、X-MOL微信公众号的推送(https://mp.weixin.qq.com/s/gkYBoM237V8EfkImLRQ3yw)。(药学院/文图 胡卿/审核)
论文链接:
(1) Gaofeng Lin, Qinlong Xu, Jiaming Li*, Zhaoxing Chu, Zhaoxing Chu, Xiaodong Ma, Qihua Zhu, Yan Zhao, Jiajia Mo, Wenfeng Ye, Li Shao, Tao Fang, Minghan He, Shaoyun Yue, Mingqi Dai. https://doi.org/10.1021/acs.jmedchem.3c01524
(2) Can Zhao, Fang Zhao, Liuqing Yang, Yang Wang*, Henian Wang, Fang Fang, Haojie Zuo, Zhi Li, Ge He, Wenhu Zhan*, Xiaodong Ma*. https://doi.org/10.1021/acs.jmedchem.4c00272